Historieta de los modelos atomicos
Original price was: $ 40.$ 35Current price is: $ 35.
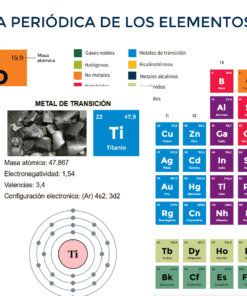
La evolución de los modelos atómicos refleja cómo ha cambiado nuestra comprensión de la materia: desde la idea filosófica de átomos indivisibles hasta complejos modelos cuánticos que explican el comportamiento de partículas subatómicas. Cada modelo aportó una visión más precisa del átomo y permitió avances científicos clave.
recibe el producto que esperabas o te devolvemos tu dinero.